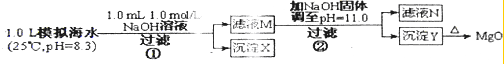
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备Mg0的实验方案( )
| 模拟海水中的离子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl- |
HCO3- |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 | Kap(CaCO2)=4.96×10-3:Kap(MgCO2)=6.82×10-5:Kap[Ca(OH)2]=4.68×10-4:注:溶液中某离子的浓度小于1.0×10-5mo1/L,可认为该离子不存在:实验过程中,假设溶液体积不变.
已知:Kap[Mg(OH)4]=5.61×10-12
下列说法正确的是( )| A.沉淀物x为CaCO3 | | B.滤液M中存在Mg2+,不存在Ca2+ | | C.滤液N中存在Mg2+、Ca2+ | | D.步骤②中若改为加入4.2gNaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
|

