
| 下列物质中含有极性共价键的是 |
|
[ ] |
| A.单质碘 B.氯化镁 C.溴化钾 D.水 |
| 用一带静电的有机玻璃棒靠近A、B两种纯液体的细流,现象如图所示。据此分析A、B两种液体分子的极性正确的是 |
 |
|
[ ] |
| A.A是极性分子,B是非极性分子 B.A是非极性分子,B是极性分子 C.A、B都是极性分子 D.A、B都是非极性分子 |
| 下列叙述中正确的是 |
|
[ ] |
| A.离子化合物中不可能存在非极性键 B.非极性分子中不可能既含有极性键又含有非极性键 C.非极性分子中一定含有非极性键 D.不同非金属元素原子之间形成的化学键都是极性键 |
| 四氯化硅的分子结构与四氯化碳类似,对其作出如下推断:①四氯化硅晶体是由分子构成的;②常温、常压下四氯化硅是液体;③四氯化硅的分子是由极性键形成的分子;④四氯化硅熔点高于四氯化碳。其中正确的是 |
|
[ ] |
| A.只有① B.只有①② C.只有②③ D.①②③④ |
| CO2、BF3、CCl4都是非极性分子,NH3、H2S都是极性分子,下列关于推出ABn型分子是非极性分子的经验规律,正确的是 |
|
[ ] |
| A.所有原子在同一平面内 B.分子中不含有氢原子 C.A的化合价等于主族序数(n>1) D.A的相对原子质量小于B |
| 下列各组物质中,都是由极性键构成的极性分子的一组是 |
|
[ ] |
| A.CH4和Br2 B.NH3和H2O C.H2S和CCl4 D.CO2和HCl |
| 下列物质的变化,破坏的主要是分子间作用力的是 |
|
[ ] |
| A.碘单质的升华 B.氯化钠溶于水 C.将水加热变成气态 D.氯化铵受热分解 |
| 有下列两组命题,乙组中命题正确,且能用甲组命题加以正确解释的是 |
 |
|
[ ] |
| A.I① B.Ⅱ② C.Ⅲ③ D.Ⅳ④ |
| 下列物质只需克服范德华力就能汽化的是 |
|
[ ] |
| A.液态二氧化硫 B.液态氨 C.液态氟化氢 D.水 |
| 下列事实,不能用氢键知识解释的是 |
|
[ ] |
| A.水和乙醇可以完全互溶 B.氨气容易液化 C.干冰易升华 D.液态氟化氢化学式有时写成(HF)n的形式 |
| 下列关于氢键的说法中正确的是 |
|
[ ] |
| A.每个水分子内含有两个氢键 B.在水蒸气、水和冰中都含有氢键 C.分子间形成氢键使物质的熔点和沸点升高 D.HF的稳定性很强,是因为其分子间能形成氢键 |
| 下列有关水的叙述中,可以用氢键的知识来解释的是 |
|
[ ] |
| A.水比硫化氢气体稳定 B.水的熔沸点比硫化氢的高 C.氯化氢气体易溶于水 D.0℃时,水的密度比冰大 |
| 下列物质中不存在氢键的是 |
|
[ ] |
| A.冰醋酸中醋酸分子之间 B.一水合氨分子中的氨分子与水分子之间 C.液态氟化氢中氟化氢分子之间 D.可燃冰中甲烷分子与水分子之间 |
| 下列说法中不正确的是 |
|
[ ] |
| A.分子间作用力是分子间相互作用力的总称 B.范德华力与氢键可同时存在于分子之间 C.分子间氢键的形成除使物质的熔沸点升高外,对物质的溶解度、硬度等也有影响 D.氢键是一种特殊的化学键,它广泛地存在于自然界中 |
氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如:邻羟基苯甲醛分子 ( )内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子 )内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(  )之间也存在氢键(分子间氢键),则两者的熔沸点的相对大小关系是 )之间也存在氢键(分子间氢键),则两者的熔沸点的相对大小关系是 |
|
[ ] |
| A.前者>后者 B.前者<后者 C.前者=后者 D.无法估计 |
| 下列关于氢键的说法中正确的是 |
|
[ ] |
| A.氢键属于共价键 B.氢键只存在于分子之间 C.氢键的形成使物质体系的能量最大程度地降低 D.在物质内部一旦形成氢键,氢键就再也不会断裂、生成 |
| 下列说法正确的是 |
|
[ ] |
| A.含有非极性键的分子一定是非极性分子 B.非极性分子中一定含有非极性键 C.由极性键形成的双原子分子一定是极性分子 D.键的极性与分子的极性无关 |
| 以下说法中正确的是 |
|
[ ] |
| A.氢键是化学键 B.甲烷可与水形成氢键 C.乙醇分子跟水分子之间存在氢键 D.碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
| 图中两分子的关系是 |
 |
|
[ ] |
| A.互为同分异构体 B.是同一种物质 C.是手性分子 D.互为同系物 |
| 根据人们的实践经验,一般来说,极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂,称为“相似相溶原理”。根据“相似相溶原理”,下列现象不能用这一原理解释的是 |
|
[ ] |
| A.氯化氢易溶于水 B.氯气易溶于氢氧化钠溶液 C.碘易溶于四氯化碳 D.碘难溶于水 |
| (1)根据“相似相溶原理”判断,下列物质中,易溶于水的是 |
|
[ ] |
| A.NH3 B.HF C.I2 D.Br2 |
| (2)易溶于CCl4的是 |
|
[ ] |
| A.NH3 B.HF C.I2 D.Br2 |
| 欲提取碘水中的碘,不能选用的萃取剂是 |
|
[ ] |
| A.酒精 B.CCl4 C.直馏汽油 D.苯 |
| 在有机物分子中,当碳原子连有四个不同的原子或原子团时,这种碳原子称为“手性碳原子”,凡具有一个手性碳原子的化合物一定具有光学活性。例如,有机物(如下)中含有一个手性碳原子,它具有光学活性,它发生下列化学反应时,得到的有机产物中也具有光学活性的是 |
 |
|
[ ] |
| A.与乙酸发生酯化反应的产物 B.被铜网催化氧化后的产物 C.与银氨溶液作用后的产物 D.被H2还原后的产物 |
| 范德华力为akJ/mol,化学键为bkJ/mol,氢键为ckJ/mol,则a、b、c的大小关系是 |
|
[ ] |
| A.a>b>c B.b>a>c C.c>b>a D.b>c>a |
| 一生获得过两次诺贝尔奖,曾经在关于化学键本质的研究及其在物质结构中的应用方面作出重大贡献的化学家是 |
|
[ ] |
| A.居里夫人 B.鲍林 C.爱因斯坦 D.门捷列夫 |
| 下列叙述中正确的是 |
|
[ ] |
| A.以非极性键结合起来的双原子分子一定是非极性分子 B.以极性键结合起来的分子一定是极性分子 C.非极性分子只存在于双原子单质分子里 D.非极性分子中一定含有非极性共价键 |
| 判断AB2型分子是极性分子的主要依据是 |
|
[ ] |
| A.分子中存在极性键 B.分子中存在非极性键 C.直线形结构 D.非直线形结构 |
| 下列物质变化的现象,不能通过分子间作用力来解释的是 |
|
[ ] |
| A.HF、H2O的沸点比HCl、H2S的沸点高很多 B.正戊烷的沸点比新戊烷的沸点高 C.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低 D.氧化钠的熔点比氧化镁的熔点低 |
| 瑞典皇家科学院将2003年诺贝尔化学奖授予在水通道细胞膜(疏水性跨膜多肽类物质)研究方面作出开创性贡献的两位美国科学家。水分子通过膜通道的中部时发生旋转,从而破坏了水分子因氢键形成的网状结构,阻止了质子利用氢键网格跳跃前进的可能。下列关于水通道膜的说法错误的是 |
|
[ ] |
| A.水分子和离子都能自由通过膜通道 B.膜通道是一种特殊结构的蛋白质 C.题干中的“质子”是指H+ D.水通道膜广泛存在于动植物和微生物中 |
| 已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子表示H2SO4。一般而言,该式子中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是 |
|
[ ] |
| A.HClO3 B.H2SeO3 C.H3BO3 D.HMnO4 |
| 下列叙述中正确的是 |
|
[ ] |
| A.P4和NO2都是共价化合物 B.CCl4和NH3都是以极性键结合的极性分子 C.在CaO和SiO2晶体中,都不存在单个小分子 D.甲烷的结构式为是  对称的平面结构,所以是非极性分子 对称的平面结构,所以是非极性分子 |
| 已知同种元素的含氧酸中,成酸元素的化合价越高,其含氧酸的酸性越强。下列无机含氧酸中酸性最强的是 |
|
[ ] |
| A.HNO2 B.H2SO3 C.HClO3 D.HClO4 |
| 2001年11月17日,意大利一所大学的科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子(O4),并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,则下列关于该氧分子的说法中正确的是 |
|
[ ] |
| A.该分子是氧元素的一种同位素 B.该物质与臭氧互为同素异形体 C.合成O4的反应属于核反应 D.该分子是由极性键构成的极性分子 |
| 已知同周期的X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4> H2YO4>H3XO4,下列判断正确的是 |
|
[ ] |
| A.阴离子的还原性按X、Y、Z的顺序增强 B.单质的氧化性按X、Y、Z的顺序减弱 C.元素的非金属性按X、Y、Z的顺序增强 D.气态氢化物的稳定性按X、Y、Z的顺序减弱 |
| 下列事实与氢键无关的是 |
|
[ ] |
| A.液态氟化氢中有三聚氟化氢(HF)3的存在 B.冰的密度比液态水的小 C.乙醇比甲醚(CH3-O-CH3)更易溶于水 D.NH3比PH3稳定 |
| 六氟化硫分子呈正八面体形(如图所示),难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应,则下列有关六氟化硫的推测正确的是 |
 |
|
[ ] |
| A.SF6易燃烧生成二氧化硫 B.SF6中各原子均达到8电子稳定结构 C.高温条件下,SF6微弱水解生成H2SO4和HF D.SF6是极性分子 |
| 对于X-O-H型化合物,X是除去H、O外的其他元素时,下列说法正确的是 |
|
[ ] |
| A.当X是活泼金属元素时,它一定是强碱 B.当X是非金属性很强的元素时,X-O-H一定为酸 C.X-O-H的水溶液不能导电 D.X-O-H的构型一定是直线形的 |
| 以下说法正确的是 |
|
[ ] |
| A.若把H2S分子写成H3S,违背了共价键的饱和性 B.H3O+的存在,说明共价键不应有饱和性 C.所有的共价键都有方向性 D.凡是有空轨道的微粒,都能接收孤对电子形成牢固的配位键 |
美国诺尔斯、夏普雷斯及日本野依良治三位化学家对通过使用快速和可控的重要化学反应来合成某些手性分子的方法有卓越贡献,被授予2001年诺贝尔化学奖。所谓手性分子是指在分子结构 中,R1、R2、R3、R4为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子即为手性碳原子。例如:普通氨基酸中的丙氨酸即为手性分子,它有两种形状:(S)-丙氨酸和(R)- 丙氨酸,它们互为镜像(如图所示)。不管我们如何旋转这些图形都不能让它们互相重叠,这种现象称为对映异构。回答下列问题 中,R1、R2、R3、R4为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子即为手性碳原子。例如:普通氨基酸中的丙氨酸即为手性分子,它有两种形状:(S)-丙氨酸和(R)- 丙氨酸,它们互为镜像(如图所示)。不管我们如何旋转这些图形都不能让它们互相重叠,这种现象称为对映异构。回答下列问题 |
 |
| (1)乳酸[CH3CH(OH)COOH]是人体生理活动的一种代谢产物,它是否存在对映异构? ___________________ (2)乳酸分子中可能处于同一平面的原子数目最多有__________个 |
| 判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示 |
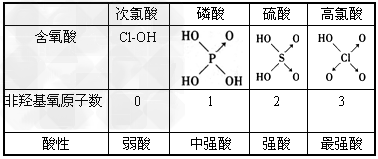 |
| (1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构式分别为______,_______。 (2)亚磷酸和亚砷酸与过量的氢氧化钠溶液反应的化学方程式分别为: ①___________________; ②_______________________。 (3)在亚磷酸和亚砷酸中分别加入浓盐酸,反应情况为____________________________;写出化学方程式:________________________。 |
| (1)①H2~H2、②H2O~H2O、③CH3OH~H2O、 ④CCl4~H2O,上述各对分子之间只存在范德华力的有____,存在氢键的有____。 (2)物质①苯、②NH3、③C3H8、④  、⑤对羟基苯甲醛、⑥CH3CH2OH中,能形成分子间氢键的有____,能形成分子内氢键的有____,不能形成氢键的有____。 、⑤对羟基苯甲醛、⑥CH3CH2OH中,能形成分子间氢键的有____,能形成分子内氢键的有____,不能形成氢键的有____。 (3)晶体①氯化钠、②干冰、③金刚石、④金属钠中,其构成微粒之间的作用力分别是___、____、____、____。其中熔点最高的是____,熔点最低的是____(填序号)。 |
| 碘在不同溶剂中呈现紫色、棕色,一般认为溶液呈紫色时表明溶解了“碘分子”并未和溶剂发生很强的结合。已知不同温度下,碘在石蜡油中的溶液呈紫色或棕色。温度低时溶液呈 _________色,温度高时溶液呈_________色,因为_________。 |
| 用A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰(CO2)、F.固体碘,填下列空白 (1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是____,熔点最高的是____,熔点最低的是____。 (2)晶体中既存在离子键又存在共价键的是____;只含有离子键的是 __________。 (3)由极性键构成的非极性分子是____。 (4)可能溶于四氯化碳的有____。 |
| 美国诺尔斯、夏普雷斯及日本野依良治三位化学家在发现和合成手性催化剂方面有卓越贡献,被授予2001年诺贝尔化学奖,以表彰他们发现手性分子可以用来加速并控制化学反应的创造性工作。含手性碳原子的物质通常具有不同的光学特性(称为光学活性)。 (1)根据报道,最新合成的有机物A  具有光学活性,若要使A通过反应失去光学活性,则发生的反应类型不可能是________(填字母) 具有光学活性,若要使A通过反应失去光学活性,则发生的反应类型不可能是________(填字母)A.酯化反应 B.水解反应 C.氧化反应 D.还原反应 E.消去反应 F.加成反应 G.银镜反应 (2)某链烃B的分子式为C7H10,在B的各种结构(不考虑一个碳原子同时连两个双键的结构)中,含有手性碳原子,且与足量氢气发生加成反应后仍具有光学活性的有机物有五种,已知其中两种的结构简式为 |
 |
| 则另三种的结构简式为____________,_______________,__________________。 |
| PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题: (1)PtCl2(NH3)2是平面正方形结构,还是四面体结构?__________________。 (2)请在以下横线上画出这两种固体分子的几何构型图: 淡黄色固体:________________,黄绿色固体:_________________。 (3)淡黄色固体物质是由____分子组成,黄绿色固体物质是由分子组成____________(填“极性”或“非极性”)。 (4)黄绿色固体在水中溶解度比淡黄色固体大,原因是_______________________。 |
| A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子的最外层电子数比次外层电子数少2个。 (1)A、B、C的元素符号分别为A____,B____,C____。 (2)B原子的电子排布式为________。 (3)BC2是由____键组成的____(填“极性”或“非极性”)分子,分子的立体结构为____。 |
| 数10亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的主要成分 |
 |
| 用上表所涉及的分子填写下列空白。 (1)含有10个电子的分子有(填化学式,下同)____; (2)由极性键构成的非极性分子有____; (3)与H+可直接形成配位键的分子有____; (4)沸点最高的物质是____,用所学知识解释其沸点最高的原因____; (5)分子中不含孤对电子的分子(除稀有气体外)有____,它的立体构型为________; (6)极易溶于水、其水溶液呈碱性的物质的分子是____,它之所以极易溶于水是因为它的分子和水分子之间可形成____; (7)CO的结构可表示为OC,与CO结构最相似的分子是____,这两种结构相似的分子中,分子的极性____(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。 |
| 某学生在如图所示的装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题。 |
 |
| (1)第一步,在分液漏斗中依次加入10mL苯和5mL液溴,使之混合均匀,此时观察到溴溶于苯,不反应,溶液呈深红棕色。 第二步,打开分液漏斗活塞,将苯、溴混合液按一定速度逐滴加入玻璃管甲中的铁丝上,观察到的现象是______________________;从上述两步观察到的现象的差异,可得出的结论是__________。 (2)第三步,几分钟后,打开胶皮管夹A和B,使反应混合液流入U形管中,打开管夹B的原因是__________;然后通过分液漏斗向U形管中加入适量的氢氧化钠溶液,目的是____________________。 (3)第四步,关闭胶皮管夹A和B,连同A和B一起取下U形管,用力振荡并静置后,观察到溴苯的颜色是__________,它在U形管中液体的层__________(填“上”或“下”),此步关闭管夹A和B的目的是____________________。 (4)要证明上述溴与苯的反应是取代反应而不是加成反应,装置乙中:小试管内的液体是__________(填名称,下同),作用是______________;锥形瓶内的液体是______________,作用是__________;反应后,向锥形瓶内滴加__________溶液,作用是__________;此外,装置乙还能起到作用__________。 (5)写出上述苯与溴反应的化学方程式:________________________。 |
| 已知H2O2分子的结构如图所示,H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,氧原子则在书的夹缝上,书面夹角为94°,而O-H键与O-O键的夹角均为97°。试回答 |
 |
| (1)写出H2O2分子的电子式和结构式______________________; (2)写出分子内的键型________________; (3)估计它难溶于CS2,简要说明原因______________________; (4)指出氧元素的化合价,简要说明原因____________________。 |